Hoplocampe du poirier en verger biologique :
mieux le connaître pour mieux le contrôler
La production de poire biologique est soumise aux aléas climatiques, comme le gel en 2021 par exemple, et aux dégâts des bioagresseurs. Le contrôle des principaux ravageurs du poirier est crucial, le niveau des pertes occasionnées pouvant remettre en question la viabilité économique de cette production. L’hoplocampe du poirier (Hoplocampa brevis) fait partie des ravageurs dont le contrôle est délicat en arboriculture biologique. Cet insecte peut en effet créer de mauvaises surprises : le niveau de perte peut varier de 0 à 80% d’une année à l’autre.
Il est important de savoir reconnaître cet hyménoptère : à l’âge adulte, il ne mesure que 4-5 mm, mais ce sont ses larves qui causent les dégâts sur ou à l’intérieur des fruits. Repérer sa présence dans les vergers est possible grâce à la pose de pièges blancs englués à positionner stratégiquement dans les parcelles. Les techniques pour contrôler les dégâts en vergers bio reposent sur du piégeage massif des hoplocampes adultes, en optimisant le positionnement et la densité des pièges englués. Des méthodes de régulation biologiques (nématodes entomopathogènes, prédation par les poules, parasitoïdes) sont également actuellement à l’étude.
Par Claude-Eric Parveaud et Maxime Jacquot, relecture Laetitia Fourrié – Décembre 2023
Qui est Hoplocampa brevis ?
L’hoplocampe du poirier est un hyménoptère réalisant une seule génération par an. Les adultes émergent du sol au début du printemps. Les mâles apparaissent plus tôt que les femelles mais ils restent rares car la reproduction est surtout parthénogénétique (sans fécondation).
La période de vol est d’environ 5 jours mais elle peut varier selon les conditions climatiques. Sa durée de vie est d’une à deux semaines, et sa fécondité est de 30 œufs environ. L’œuf est inséré dans le calice de la fleur, son incubation est de 10 à 13 jours. La larve mesure de 8 à 12mm et sa durée de développement est de 20 à 34 jours. Pendant ce stade, la larve peut occasionner des dégâts sur plusieurs poirettes. Lorsqu’elle atteint son dernier stade larvaire, celle-ci descend au sol et forme un cocon. Une partie des cocons émergera au printemps suivant, tandis que 25% n’émergeront que les années d’après.

Ne pas confondre avec l’hoplocampe du pommier
L’hoplocampe du poirier (H. brevis) ressemble à l’hoplocampe du pommier (H. testudinea). Au stade adulte, l’hoplocampe du poirier se distingue de l’hoplocampe du pommier par sa plus petite taille : il mesure 4 à 5 mm alors que l’hoplocampe du pommier mesure 6 à 7 mm. La partie supérieure du thorax (appelée scutum) de l’hoplocampe du poirier a des taches oranges/marrons (photo C), alors que le thorax de l’hoplocampe du pommier est entièrement noir.
Repérer sa présence… et les premiers dégâts !
Tout comme pour l’hoplocampe du pommier, la pose de pièges blancs englués permet de vérifier sa présence au verger. La pose de pièges se fait au stade bouton floral (D-E) par la pose de 3 pièges minimum par parcelle. En effet, la répartition des hoplocampes étant fréquemment très hétérogène, il est prudent de couvrir différentes zones dans une parcelle. Notons que les captures sont généralement plus abondantes en périphérie du verger.
Il est également recommandé de positionner les pièges dans les variétés précoces, intermédiaires et tardives. Deux observations par semaine semblent nécessaires, l’émergence pouvant être rapide. Dans certains cas, l’émergence des adultes peut intervenir dès le début du stade D : soyez vigilant ! Des travaux italiens sur 21 vergers ont montré que le niveau de dégâts est significativement corrélé au nombre de capture. Dans leurs conditions, le seuil de 20 individus / piège Rebell® correspondait à 7% de inflorescences contaminés. Mais cette valeur est toutefois délicate à extrapoler, beaucoup de facteurs influencent le niveau de capture (densité des pièges, intensité de la floraison…).

Les dégâts sont causés par les larves, visibles sur et/ou à l’intérieur des fruits. Les attaques primaires correspondent à un sillon superficiel sous l’épiderme du jeune fruit. La larve progresse vers l’intérieur du fruit pour y manger les pépins. Les attaques secondaires sont les plus visibles au verger, il s’agit de trou de 3mm de diamètre, creusé par la larve. Des déjections sont visibles sur le fruit.

Contrôler les dégâts en verger biologique
L’objectif du piégeage massif par des pièges englués blancs est de capturer un maximum d’hoplocampes adultes avant qu’ils ne pondent dans les fleurs. Plusieurs types de pièges commerciaux existent (Rebell® et CatchIT® d’Andermatt, par exemple). Des pièges peuvent aussi être fabriqués à partir de support en plastique blanc (bidon vide, par exemple) qui sont ensuite englués. Les conditions d’installation des pièges sont les mêmes que pour la détection, seule la densité est plus élevée.
La densité minimum de pièges à installer pour observer une baisse significative des dégâts dépend du niveau de présence de l’insecte : il est donc délicat de la définir. Des densités de 150 à 300 pièges par hectare sont préconisées pour l’hoplocampe du pommier dans certains documents, ce qui semble très élevé et difficile à mettre en œuvre. Les références étant peu nombreuses, c’est souvent le budget et le temps de pose disponible qui limite le nombre de piège dans la parcelle.
Les pièges sont à positionner à une hauteur de 1 m minimum : un piège situé à une hauteur de 0,5 m capturera deux fois moins d’hoplocampes qu’à 1 m. Le nombre d’hoplocampes capturés sur un piège Rebell® peut atteindre plus de 300 individus. Afin d’éviter le piégeage des auxiliaires et des polinisateurs, il est conseillé de retirer les pièges englués à la chute des pétales.
L’application de quassine pendant la floraison permet de contrôler les populations d’hoplocampe du poirier. Cependant, à l’occasion de la réécriture du règlement bio européen (annexe 1 CEE R 2021/1165), entré en application le 1er janvier 2022, l’extrait de Quassia a disparu de l’annexe I, où il figurait précédemment en tant qu’insecticide répulsif. Chaque année, il convient de se renseigner sur l’évolution de son statut réglementaire (dérogation, reconnaissance en tant que substance de base).
Blanc, bleu, jaune ou rouge ?
La couleur des pièges englués est cruciale car elle détermine son niveau d’attractivité sur les hoplocampes du poirier, mais aussi sur l’ensemble des insectes présents, donc sur les auxiliaires et les polinisateurs. L’efficacité et la sélectivité des quatre couleurs de pièges ont été évaluées par plusieurs partenaires (Grab, CTIFL, La Pugère) dans le Sud-Est de la France en 2021 et 2022.
Les observations réalisées dans trois vergers situés dans différents environnements montrent que les pièges blancs sont significativement plus attractifs pour l’hoplocampe du poirier que les pièges bleus, jaunes et rouges.
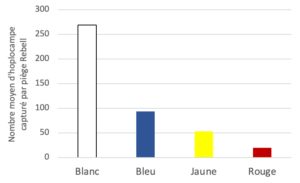
Sur deux sites, le pourcentage d’auxiliaires et polinisateurs (araignées, chrysopes, éphéméroptères, hémérobes, lépidoptères, syrphes et coccinellidés) capturés non-intentionnellement sur les pièges colorés était compris entre 0,6 à 2,2% du total, représentant à 1 à 5 individus. De nombreux diptères sont aussi souvent capturés.
L’effet de l’environnement semble prépondérant. Certains polinisateurs tels que les osmies et abeilles peuvent être attirés par les pièges blancs pendant la floraison. Il convient donc d’éviter la proximité de ruches, et de retirer les pièges dès la chute des pétales des fleurs du poirier.
Premier test de pièges blancs CatchIT® en verger non palissé
Les possibilités de mise en place de pièges blancs CatchIT® (Andermatt) ont été évaluées en verger non palissé. En effet, l’installation du piège sous forme de ruban englué est possible sur les fils de palissage. Lorsqu’il n’y en a pas, des solutions sont à trouver… L’installation du ruban sur des poteaux (supportant des filets anti-insectes) et directement sur les charpentières et branches des arbres a été testée. Les premières observations montrent que l’installation sur les charpentières et branches n’a pas permis de maintenir le ruban suffisamment tendu dans le temps. A surface équivalente, l’installation sur un poteau permet de capturer autant d’hoplocampe qu’un piège Rebell®, mais ce positionnement a l’inconvénient de ne plus bénéficier des deux faces engluées, une des faces étant collée sur le poteau. De nouveaux tests sont à prévoir.

Efficacité des nématodes entomopathogènes
L’efficacité des nématodes pour contrôler les hoplocampes a davantage été étudiée dans le cas de l’hoplocampe du pommier. En conditions contrôlées, les nématodes entomopathogènes tels que Steinernema feltiae, S. carpocasae ou Heterorhabditis bacteriophora provoque une mortalité des larves de l’hoplocampe du pommier. En verger, l’efficacité par des applications au sol ou sur feuillage est comprise entre 0 et 70%. Cette très forte variabilité est expliquée par les conditions d’application, connues pour être déterminante : température douce, sol et/ou feuillage humide sont nécessaires, assurant la survie des nématodes. L’irrigation est donc nécessaire s’il n’y a pas de pluie.
Nématodes entomopathogènes Steinernema feltiae observés au microscope
Concernant l’hoplocampe du poirier, des travaux ont montré que 37% des larves d’hoplocampe étaient contaminées par les nématodes S. feltiae après une ou deux applications foliaires début mai, au moment où les premières larves sortent de leur premier fruit visité, et dans des conditions climatiques idéales. Les expérimentations conduites par le Grab en 2022 n’ont pas permis de conclure sur le niveau d’efficacité après application de nématodes entomopathogènes au sol, le nombre d’insectes capturés dans les cages à émergence étant trop faible.

La prédation des larves est-elle une solution ?
Si la capacité de poules à consommer des larves au sol n’est plus à démontrer, très peu d’études ont quantifiées la diminution des dégâts sur fruits par la consommation des larves d’hoplocampe au sol par les poules. Des travaux sur hoplocampe du pommier indiquent une diminution significative de 10 à 75% d’hoplocampe piégées dans les zones prospectées par les poules mais aucun effet n’a été observé sur les dégâts sur fruits, probablement car la diminution de la population n’était pas assez importante pour observer un effet.
La prédation des punaises (Himacerus apterus, par ex.), coccinelles, chrysopes et fourmis (Lasius sp., par ex.) sur des jeunes larves a été observée, mais non quantifiée.
Régulation naturelle par des parasitoïdes
Comme évoqué au début de cet article, l’hoplocampe du poirier vit au cours de la saison dans les poirettes, puis dans le sol. Sa régulation naturelle par des parasitoïdes pourrait donc potentiellement intervenir à ces deux niveaux, comme cela est connu pour l’hoplocampe du pommier. En effet, Lathrolestes ensator est un parasitoïde de l’hoplocampe du pommier qui pond dans les jeunes larves dans les poirettes, et Aptesis nigrocincta est une microguêpe sans aile qui pond dans les cocons situés dans le sol.
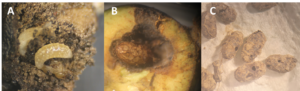
Afin d’évaluer le parasitisme des hoplocampes au niveau des poirettes, nous avons récolté des poirettes contaminées avant la descente des larves dans le sol dans quatre vergers non traités ou gérés avec très peu d’intrants. Après observation des larves et élevage des hoplocampes, aucun endoparasitoïde, comme L. ensator, n’a été observé. En revanche, nous avons observé des ectoparasitoïdes parasitant les larves d’hoplocampes, présents dans 1,3 à 17,9% des poirettes observées (photo X.A). Ces ectoparasitoïdes réalisent leurs cocons directement dans les poirettes (photo X.B).
Afin de quantifier la régulation naturelle dans le sol, des cocons d’hoplocampe situés dans des pots de terre ont été déposés dans les vergers où les ectoparasitoïdes ont été précédemment observés. Après 4 mois d’exposition à des conditions extérieures naturelles, les cocons contenus dans les pots ont été observés. Nos résultats montrent que 22% des cocons présentaient de petits trous circulaires suggérant du parasitisme (photo X.C) et un taux de mortalité totale de 53% sur cette courte période.
Bibliographie utilisée
Biologie : ephytia.inra.fr ; Antropoli et al. 1994 ; Murray & Davis, 2019 ; Leleu-Wateau et al. 2013 ; Smith et al. 1966 Nématodes entomopathogènes : Curto et al. 2007 ; Vincent et Bélair, 1992 ;
Bélair et al. 1998. Prédation : Lindhard Pederson et al. 2004 ; Vincent et al. 2019.
Vidéos techniques sur les pièges CatchIT® : https://youtu.be/9AhhnzqEs2U
Fiche technique CatchIT : https://biofruitnet.eu/wp-content/uploads/2023/01/25_PA_BIOFRUITNET_Pear_catch_that_fly_Final.pdf
Crédits photo
Claude-Eric Parveaud et Maxime Jacquot
Remerciements
Les expérimentations mentionnées ont été réalisées dans le cadre du projet Hopuce pyri (2021-2023) porté par le CTIFL et soutenu par FranceAgriMer. La production de cet article a été financée dans la cadre de l’action PRDAR de la Région Auvergne-Rhône-Alpes soutenue par le CASDAR du Ministère de l’Agriculture et de la Souveraineté Alimentaire. La responsabilité du ministère en charge de l’agriculture ne saurait être engagée.




